디지털 헬스케어 전문기업 원드롭이 분자진단 기술 기반의 현장형 코로나19 진단 솔루션(1copyTM COVID-19 MDx Kit Professional)에 대해 식품의약품안전처로부터 체외진단 의료기기 수출허가를 획득했다고 14일 밝혔다.
사용자는 검체 채취 후 별도의 유전자 추출과정 없이 최소 22분 이내에 스마트폰 앱을 통해 결과를 확인 및 관리할 수 있다. 시약의 실온 보관 및 배송이 가능한 것도 특징이다.
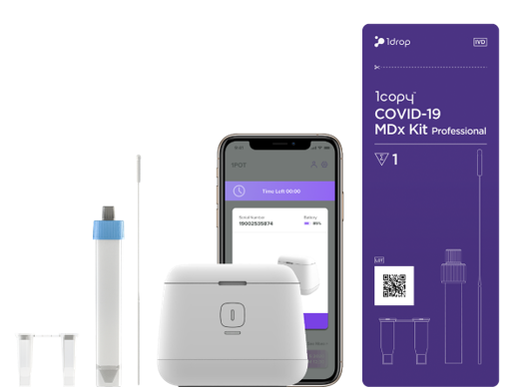
원드롭은 이번 식약처 수출허가를 계기로 헝가리, 우크라이나, 미국, 남아프리카공화국 등 해외 판매 국가를 확대하고, 분자진단 검사소를 구축하기 어려운 동남아 국가에 우선적으로 이동형 검사 사업을 추진할 계획이다.
이주원 대표는 "시장 확대를 위해 FDA-EUA 등 각국 판매허가 및 국내/외 전문가/개인용 인허가 획득을 추진 중이다. 보건소 및 보건지소, 앰뷸런스, 응급실 등에 공급해 국내 사업을 시작할 예정이다"라고 밝혔다. 또한 "이번 신제품을 플랫폼화해 코로나19감염증을 시작으로 독감, 성병, 간염, 말라리아 등 콘텐츠를 지속적으로 확장하고 기존 당뇨, 통풍, 빈혈, 고지혈증 등 만성질환 관리 솔루션과 통합한 종합 시스템을 구축해 혁신적인 모바일 헬스케어 서비스를 제공할 예정이다"라고 덧붙였다.
2017년 설립된 원드롭은 삼성전자 C랩 스핀오프 기업으로 상용 스마트폰 기반의 만성질환 관리 솔루션과 단일분자까지 정량 가능한 분자진단 기술을 바탕으로 분자진단키트를 연구 개발, 제조 및 판매하고 있다.
최근 핵산 비추출 방식(extraction-free) PCR 기술 개발, 코로나19/독감/RSV 동시진단 키트를 출시했다. FDA-EUA 및 19개국 이상의 판매허가를 획득한 후 50여개국에 총200만 테스트 이상의 진단키트를 공급하고 있다.
콘텐츠부

