식품의약품안전처는 코로나19 진단시약과 같은 체외진단 의료기기를 안전하게 관리하기 위해 제정한 체외진단 의료기기법을 시행한다고 1일 밝혔다.
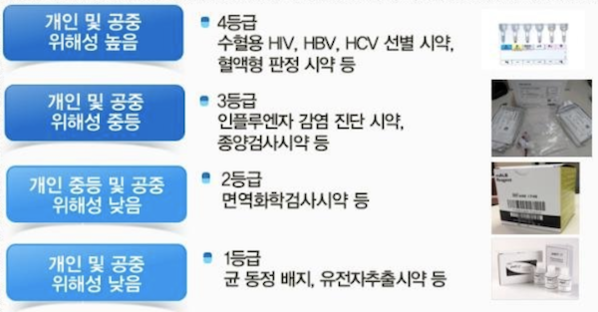
체외진단 의료기기는 안전관리 수준이 높은 순서에 따라 4등급부터 1등급까지 총 4개 등급으로 나뉜다. 의료기기 사용(진단 결과)이 개인이나 공중보건에 미치는 잠재적 위해성 등을 고려해 지정된다.
등급분류에 따라 3~4등급은 허가, 2등급은 인증, 1등급은 신고 등 맞춤형 허가·심사로 구분해 관리한다. 특히 허가·인증 때 제품성능을 확인할 수 있도록 분석적·임상적 성능시험을 구체화하기로 했다.
안전성과 유효성에 영향을 미치지 않는 경미한 변경 사항은 사후 보고하는 방식으로 신속하게 제품이 출시될 수 있게 지원하기로 했다. 의료기관과 혈액원, 의과대학 및 검체 수탁·분석기관 등이 임상적 성능시험 기관을 지정하도록 하는 등 임상적 성능시험 기반을 확대하기로 했다.
의료기관 및 유전자검사기관에 대해 차세대염기서열분석 체외진단검사 인증제를 시행하고 인증된 검사에 사용하는 체외진단 의료기기는 허가절차를 면제해주기로 했다.
앞서 식약처는 지난해 4월 30일 의료기기법에서 체외진단 의료기기법을 분리, 별도로 제정했다. 유럽연합(EU) 등 주요 선진국도 이미 체외진단 의료기기에 대한 별도 법령체계를 운영하고 있다.
김연지 기자 ginsburg@chosunbiz.com

